在中国,据统计注射肉毒素产品从2017年的170万支增长至2021年的450万支,在医美项目里,除了“水光针”、“黄金微针”等常见项目之外,打肉毒素也逐渐成为很多爱美人士的选择,它具有去除动态细纹的能力,深受爱美人士的青睐,那么,注射肉毒素产品有哪些类型呢?这类产品又该如何合规?又要经过哪些流程呢?
什么是肉毒素?“毒”在哪里?
市面上常说的肉毒素是指肉毒杆菌(Bacillus botulinus)在厌氧环境中通过繁殖过程而分泌的一种名为肉毒毒素(Botulinum neurotoxin, BoNT)的毒性蛋白,具有较强的神经毒性。
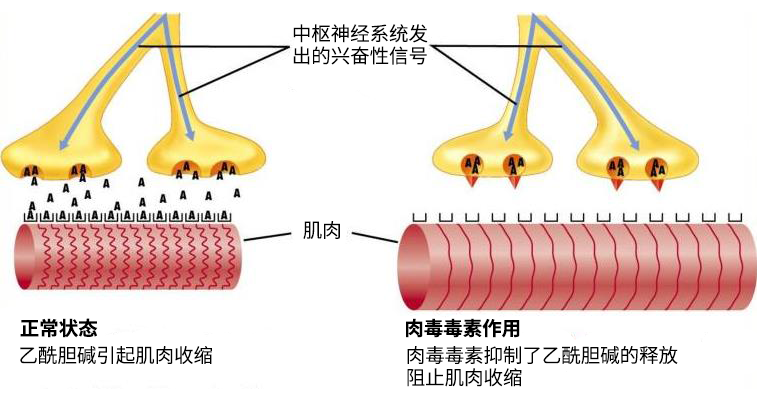
肉毒素作用机理及应用场景
而肉毒毒素能抑制运动神经末梢突触前膜关于乙酰胆碱的释放,阻断神经和肌肉之间的信号传导,从而引起肌肉的松弛性麻痹状态。
因此在医美领域,肉毒毒素的主要应用在于缓解肌肉痉挛以及去除面部的动态皱纹。
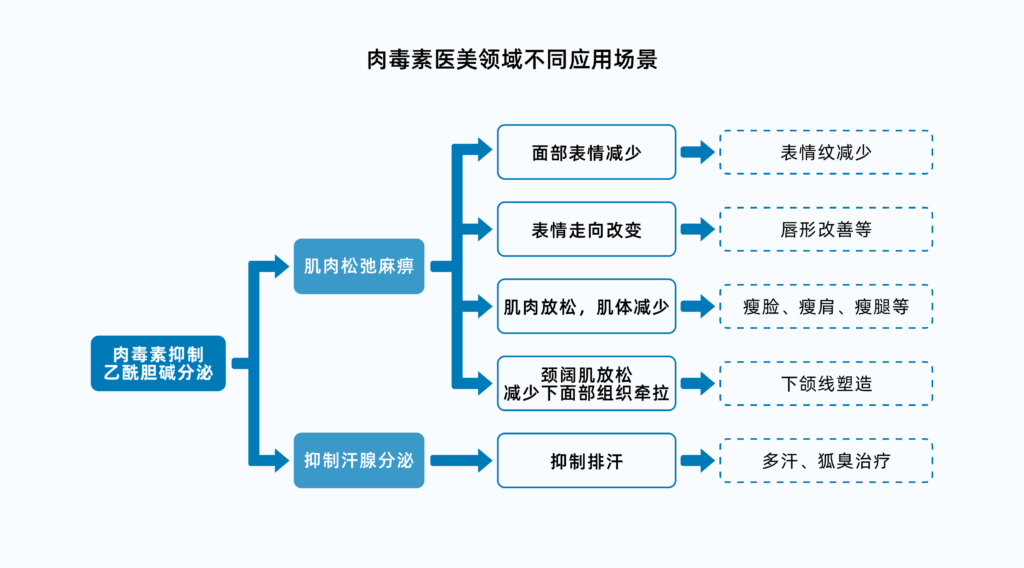
由于抗原的差异问题,肉毒毒素在具体的表达上共分为A~G七个类型,其中A、B、E、F对人有毒性作用,因此,注射用肉毒毒素一般为A和B型,A相较于B型效力更强,使用更广泛,B型主要针对对A型产生抗体的被注射者。
由于注射肉毒毒素一段时间后,失活的神经末梢将会产生神经轴突芽生,重新激发神经,注射用肉毒毒素的使用时限维持在4~6个月,因此,产品复购率相对较高。
肉毒素评估指标
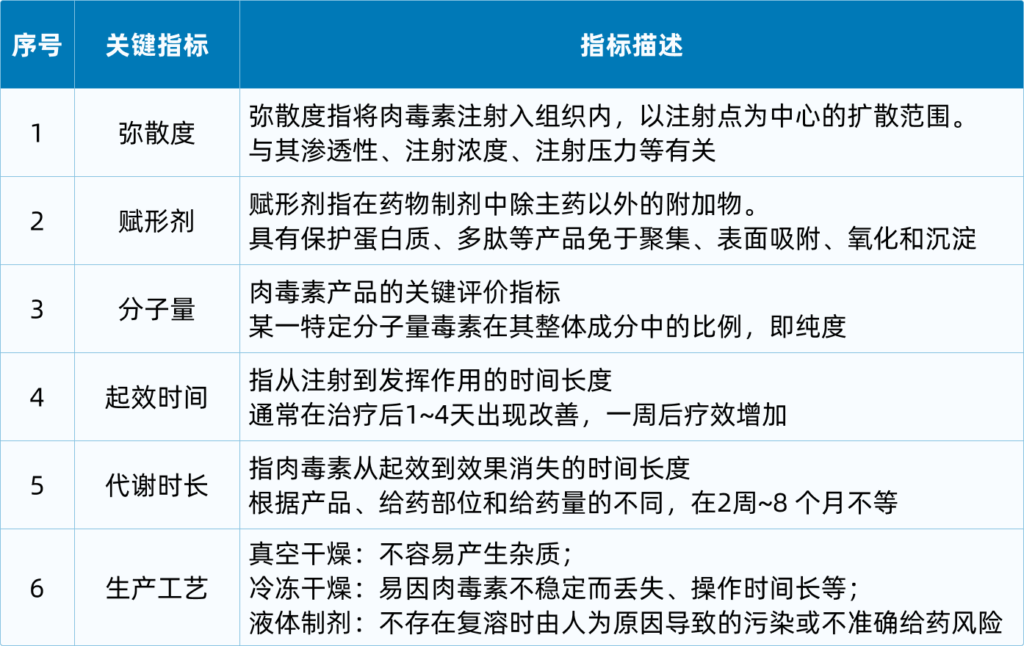
在性能评估中,衡量肉毒素的关键指标主要包括但不限于:弥散度、赋形剂、分子量大小、起效时间、代谢失常和生产工艺等,具体描述如下:
注射用肉毒素监管
肉毒素类注射产品,因具有生物毒性,所以须按照《医疗用毒性药品管理办法》等相关法律法规,对肉毒素实施全链路监管,注射用A型肉毒毒素具有阻抑神经系统的作用,使用不当会引起呼吸衰竭等症状,因此,相比于其他注射类产品,生产、销售和使用都受到更加严格的管理。
我国肉毒素产品审批流程复杂,周期长达8~10年,目前中国已上市5款左右注射用肉毒素产品。
我国药品的合规可按化学药品、中药&天然药品及生物制品分类,而肉毒毒素属于生物制剂,根据生物制剂申报及审批流程,生物制品申请注册需递交申请资料至国家药监局药品审评中心后,进行Ⅰ/Ⅱ/Ⅲ期临床试验,然后再经过申报和核查等步骤才能获得审批。
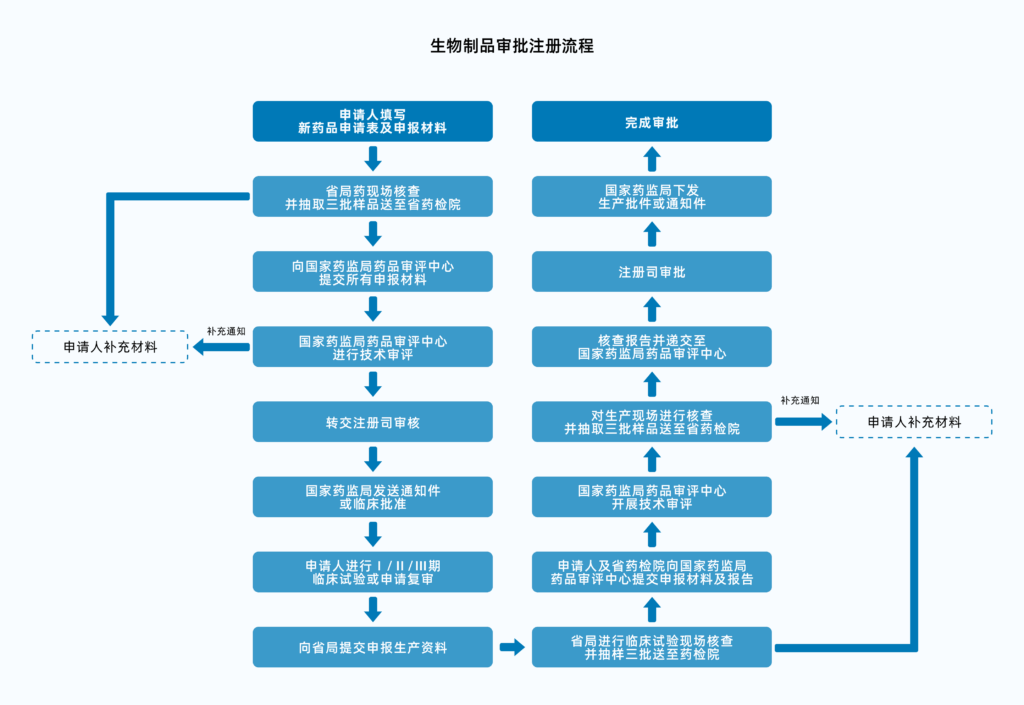
• Ⅰ期临床试验是产品首次临床试验,一般需要几十名受试者;
• Ⅱ/Ⅲ期试验范围更大,目标一般为患有适应症的受试者,而Ⅲ期临床试验则更为复杂。
