跳至内容
医疗器械变更与延续定义
- 变更注册
根据《医疗器械注册与备案管理办法》第七十九条,已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续;发生其他变化的,应当在变化之日起30日内向原注册部门备案。
当注册证载明的产品名称、型号、规格、结构及组成、适用范围、产品技术要求、进口医疗器械的生产地址等发生变动时,需办理变更注册。
- 延续注册
根据《医疗器械注册与备案管理办法》第八十二条,医疗器械注册证有效期届满需要延续注册的,注册人应当在医疗器械注册证有效期届满6个月前,向原注册部门申请延续注册,并按照相关要求提交申请资料。
延续注册申报资料要求
- 申请表
- 关联文件(企业营业执照、代理人的委托书、原医疗器械注册证等)
- 符合性声明
- 产品技术要求
- 临床评价资料等
变更及延续注册流程
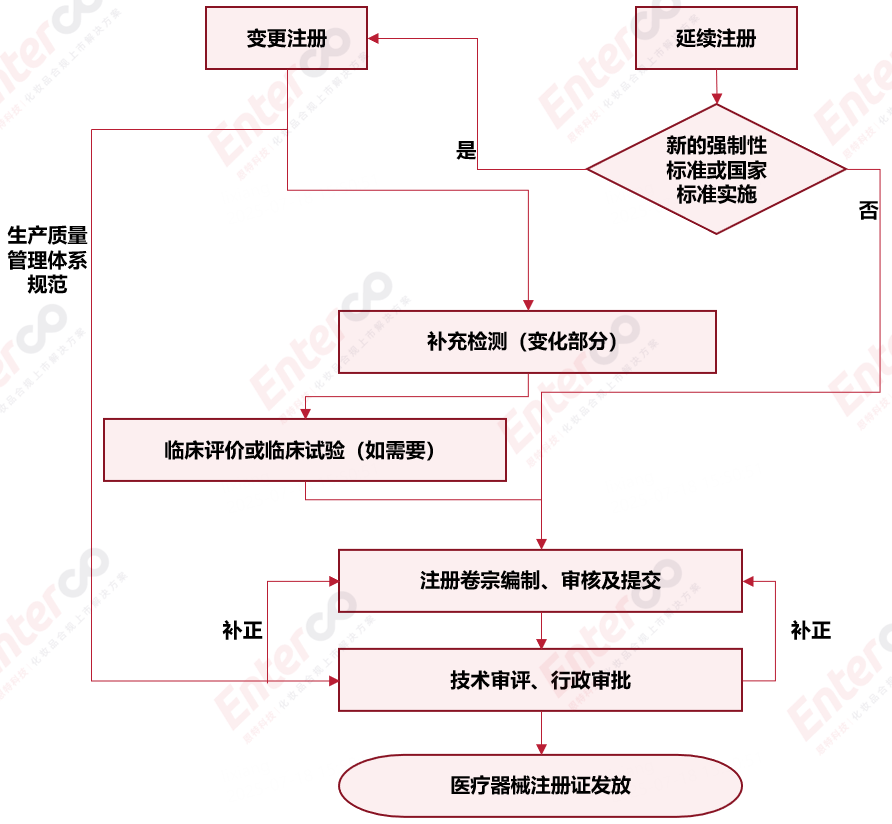
我们的服务
- 第一类医疗器械备案
- 第二类医疗器械注册
- 第三类医疗器械注册
- 进口医疗器械注册
- 体外诊断试剂注册
- 医疗器械延续注册
- 医疗器械变更注册及备案
- 医疗器械注册体系考核
- 质量管理体系辅导
- 医疗器械生产许可证
- 医疗器械法规培训

